こんにちは。今回から10月23日の「化学の日」に向けて、特集記事を出していきます。今回の特集のメインとなる内容は、化学を知る上で必要不可欠であるのにも関わらず、高校化学で多くの高校生を「化学嫌い」に突き落としてしまう単位、物質量。つまりmolです。
ということで今回は、物質量(ここからはmolと表記します)とは一体どんな単位なのかをできるだけ分かりやすく解説していきます。なお、第2回からは具体的な使用例について解説していきますのでお楽しみに。
なんか緊張する……
目次
molとはそもそも何なのか
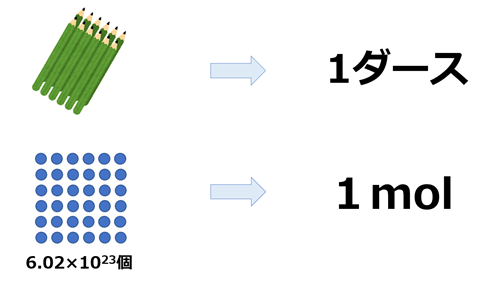
まず大前提として、molは原子や分子に使われる単位です。
6.02×1023個の原子をまとめて1molと表しています。1ダース=12個と同じ感覚で想像していただくと分かりやすいかもしれません。
ちなみに6.02×1023を「アボガドロ定数」と呼びます。
molとアボガドロ定数のちょっとすごいところ
さてここまで、少し教科書っぽい話をしてきました。
ここからはmolとアボガドロ定数の「ちょっとすごいところ」について触れていきます。
元素にはそれぞれ「原子量」というものが存在します。詳しくは第2回で触れるので、今回は「そんなのあるんだ」程度でとどめておいていただいて大丈夫です。
実は、原子を1mol分、つまり6.02×1023個分集めるとちょうど原子量の値の質量になります。
原子量が12g/molの炭素原子の場合、1molでちょうど12gです。
同じように、原子量が27g/molのアルミニウム原子の場合は、1molでちょうど27gという計算になります。
どうしてこのようになるのかについては、すでに分かっている方もいらっしゃると思いますが、第2回で詳しく触れていきます。また、次回は化学でよく出てくる物質たちにも注目しているのでお楽しみに!
今回のまとめ
今回のまとめはこんな感じ!
・molは原子や分子に使う単位
・1mol=6.02×1023個の原子
・6.02×1023をアボガドロ定数と呼ぶ
以上、謎の単位molについての話でした。
molは化学基礎で最初にして最大の強敵だと感じる方も多いかもしれません。実際子ども科学ラボの中にもmolが最初よく分からなかったという人も何人かいます。 molに対しての印象は人それぞれだとは思いますが、なんとなく苦手だったと感じている方の印象を少しでも良い方向に変えることが出来れば幸いです。
TwitterとInstagramもよろしくお願いします!


