こんにちは。化学の日第3回担当のもりとかなです。最終回の今回は応用ということで、基礎なしの化学に登場するモルの計算をしていきます。
基礎なしでモルが関係してくるのは、モル分率、モル濃度、質量モル濃度、沸点上昇、凝固点降下あたりでしょうか。第2回でも少し出てきましたね。この記事ではモル濃度と質量モル濃度の説明と沸点上昇と凝固点降下の簡単な問題を解いていきます。
目次
モル濃度は、溶液1Lに溶質が何mol溶けているかを表した濃度、モル質量濃度は、溶媒1kgに溶質が何mol溶けているかを表した濃度です。
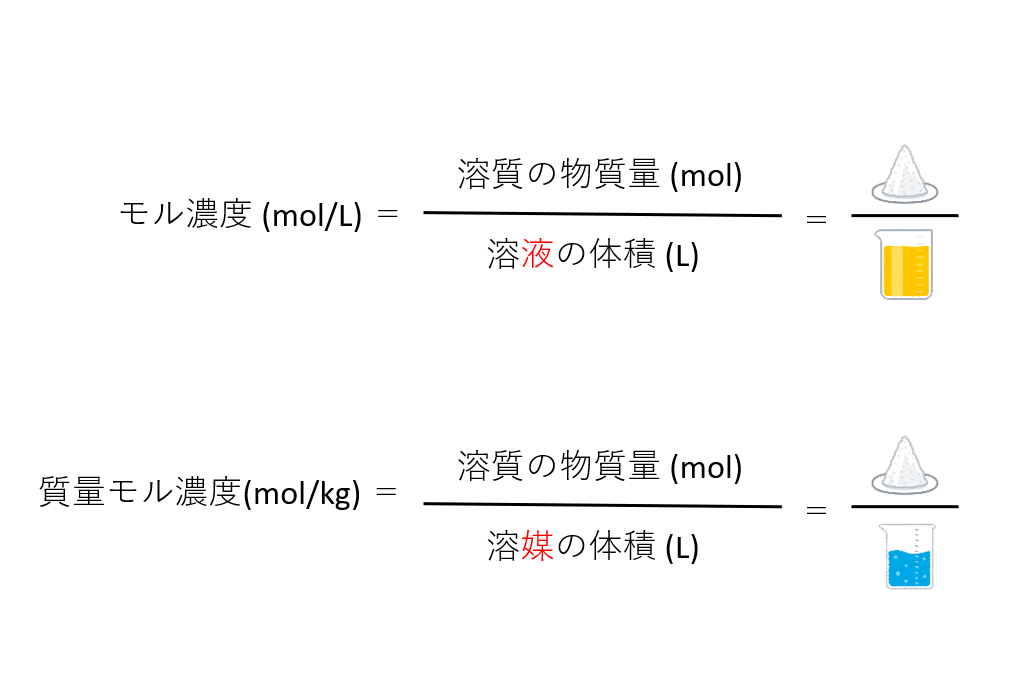
モル濃度では溶液の体積〔L〕に対し、質量モル濃度では溶媒の体積〔kg〕となっていることに注意です。化学でkg単位が登場するのはここだけなので覚えておきましょう。
まあ要はどのくらいの濃さかってことを表しているわけです。
この2つの違いには「温度変化」があります。
- モル濃度・・・温度変化によって値が変わる
- 質量モル濃度・・・温度変化によって値は変わらない
温度が高くなると溶液の体積が微妙に増えるのが理由です。
最初に沸点上昇と凝固点降下の説明を。
短く言うと、溶液では純溶媒よりも沸騰する温度は上昇し(沸点上昇)、凝固する温度は降下する(凝固点降下)。
つまり、ただの水よりも砂糖水の方が沸騰する温度は高くなるし、固まる温度は低くなるような性質のことです。
溶液の質量モル濃度が1mol/kgのときの、沸点上昇Δtbをモル沸点上昇Kb、凝固点降下度Δtfをモル凝固点降下Kfといいます。モル沸点上昇〔K・kg/mol〕、モル凝固点降下〔K・kg/mol〕のどちらも溶質の種類に関係なく、溶媒に固有の値を示します。たいてい問題文の最後で値は与えられるので覚える必要はありません。
さっそく問題を解いていきましょう。前回のように単位を頼りに計算すると楽かもしれません。
(1) 水500gに36gのグルコース(分子量180)を溶かした水溶液の沸点は何℃になるか。ただし、水のモル沸点上昇を0.52 K・kg/molとする。
(2) 2.4gの尿素(分子量60)を水100gに溶かした水溶液の凝固点は何℃か。ただし、水のモル凝固点降下を1.85 K・kg/molとする。
(1) どのくらい沸点もしくは凝固点が変化するか知りたいので、水のモル沸点上昇、モル凝固点降下の値に溶液の質量モル濃度〔mol/kg〕をかけて答えを求めます。
グルコースは mol=0.2mol、溶媒の水は500g=0.5kgなので、質量モル濃度は =0.4mol/kg
沸点上昇度は、0.52 K・kg/mol×0.4mol/kg=0.208K
したがって、水の沸点よりも0.208℃高くなるので、この水溶液の沸点は100.21℃になります。
(2) 尿素は mol=0.04mol、溶媒の水は100g=0.1kgなので、質量モル濃度は =0.4mol/kg
凝固点降下度は、1.85 K・kg/mol×0.4mol/kg=0.74K
したがって、水の凝固点よりも0.74℃低くなるので、この水溶液の凝固点は-0.74℃になります。


